Propiedades periódicas
Son características de los elementos químicos que varían de forma predecible según su posición en la tabla periódica, debido a la estructura electrónica de sus átomos. Estas propiedades permiten agrupar los elementos y predecir su comportamiento químico. Las principales propiedades periódicas son el radio atómico, la energía de ionización, la afinidad electrónica y la electronegatividad, además del carácter metálico.
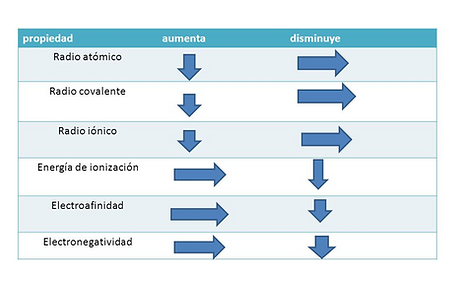
Radio atómico: Se refiere al tamaño del átomo, generalmente medido como la mitad de la distancia entre los núcleos de dos átomos adyacentes en una molécula. Dentro de un periodo (fila) de la tabla periódica, el radio atómico disminuye de izquierda a derecha, mientras que dentro de un grupo (columna) aumenta de arriba hacia abajo.
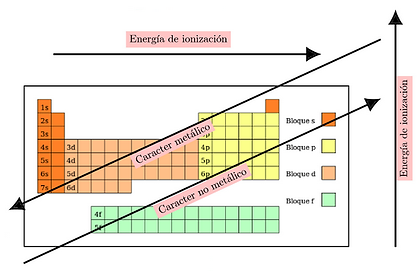
Energía de ionización: Es la energía necesaria para remover un electrón de un átomo en estado gaseoso y formar un ion positivo (catión). La energía de ionización aumenta de izquierda a derecha en un período y disminuye de arriba hacia abajo en un grupo.
Afinidad electrónica: Es la energía liberada cuando un átomo neutro en estado gaseoso acepta un electrón y se convierte en un ion negativo (anión). La afinidad electrónica generalmente aumenta de izquierda a derecha en un período y disminuye de arriba hacia abajo en un grupo.
Electronegatividad: Es la capacidad de un átomo para atraer electrones hacia sí mismo cuando está formando un enlace químico con otro átomo. La electronegatividad aumenta de izquierda a derecha en un período y de abajo hacia arriba en un grupo.
Carácter metálico: Se refiere a la tendencia de un elemento a mostrar las propiedades típicas de los metales, como brillo, conductividad eléctrica y térmica. El carácter metálico disminuye de izquierda a derecha en un período y aumenta de arriba hacia abajo en un grupo.