
Electronegatividad y carácter metálico
La electronegatividad y el carácter metálico son propiedades químicas opuestas. Los elementos con baja electronegatividad tienden a tener un carácter metálico alto, mientras que los elementos con alta electronegatividad tienden a tener un carácter no metálico alto.
Electronegatividad:
-
La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico.
-
La electronegatividad aumenta de izquierda a derecha a lo largo de un período en la tabla periódica y de abajo hacia arriba dentro de un grupo.
-
Los elementos con mayor electronegatividad son los no metales, y los elementos con menor electronegatividad son los metales.
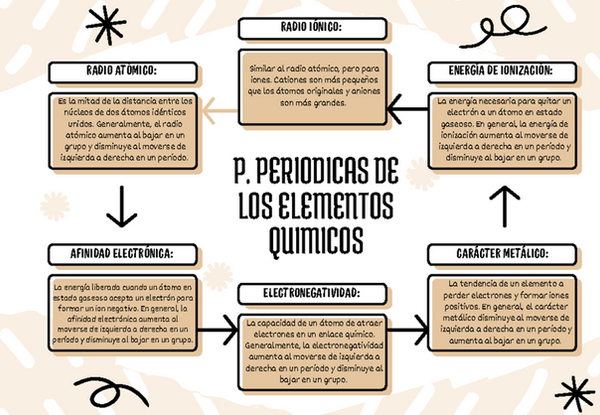
Carácter metálico:
-
El carácter metálico se refiere a la tendencia de un elemento a perder electrones y formar iones positivos (cationes).
-
El carácter metálico disminuye de izquierda a derecha a lo largo de un período en la tabla periódica y aumenta de arriba hacia abajo dentro de un grupo.
-
Los metales tienen un carácter metálico alto, mientras que los no metales tienen un carácter metálico bajo.
Relación entre electronegatividad y carácter metálico:
-
La relación entre la electronegatividad y el carácter metálico es inversa. A medida que la electronegatividad aumenta, el carácter metálico disminuye, y viceversa.
-
Los metales, con su baja electronegatividad, tienen una fuerte tendencia a perder electrones y formar cationes, lo que se asocia con un alto carácter metálico.
-
Los no metales, con su alta electronegatividad, tienen una fuerte tendencia a ganar electrones y formar aniones, lo que se asocia con un bajo carácter metálico.