
Elementos de transición
Los elementos de transición son un grupo de elementos químicos ubicados en los grupos 3-12 de la tabla periódica, caracterizados por tener orbitales d o f parcialmente llenos en su estado fundamental o en sus cationes. Estos elementos exhiben propiedades metálicas y son conocidos por su capacidad para formar iones con diferentes cargas, compuestos coloreados, y por su uso como catalizadores.

Características principales:
-
Estados de oxidación variables: Pueden formar cationes con diferentes cargas debido a la participación de los electrones d en la formación de enlaces.
-
Compuestos coloreados: Muchos compuestos de transición son coloreados debido a las transiciones electrónicas en los orbitales d.
-
Catalizadores: Son ampliamente utilizados como catalizadores en diversas reacciones químicas debido a su capacidad para cambiar sus estados de oxidación y adsorber sustancias.
-
Configuración electrónica: La característica principal de los elementos de transición es que tienen electrones en orbitales d o f parcialmente llenos.
-
Propiedades metálicas: Presentan propiedades típicas de metales, como alta conductividad eléctrica y térmica, brillo metálico, y maleabilidad.
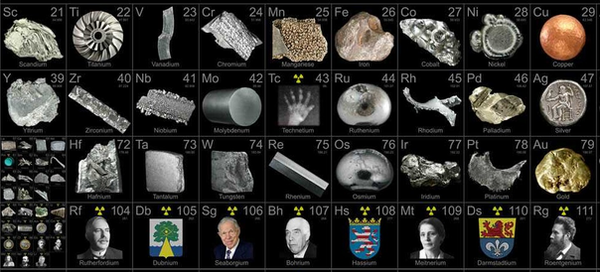
Ejemplos:
-
Bloque d: Hierro (Fe), cobre (Cu), plata (Ag), oro (Au), níquel (Ni), cobalto (Co), zinc (Zn), entre otros.
-
Bloque f: Lantánidos y actínidos, también conocidos como elementos de transición interna.